Bei einer konjugierte Addition addiert ein Nukleophil an eine C-C-Doppelbindung. Die konjugierte Addition wird auch Michael-Addition genannt. Früher umfasste die Michael-Addition nur die konjugierte Addition von Kohlenstoff-Nukleophilen, wobei neue C-C-Bindungen geknüpft wurden. Heutzutage findet sie jedoch auch Anwendung bei der Knüpfung von C-O-, C-S- und C-N-Bindungen. Die folgende Reaktion verläuft zum Beispiel nach dem Mechanismus einer Michael-Addition.

Doch wie läuft diese Reaktion ab? Welcher Mechanismus liegt ihr zugrunde? Wie kann man sie beeinflussen oder gar komplett steuern? Diese Fragen wollen wir uns im Folgenden anschauen.
Inhaltsverzeichnis
Der Mechanismus der konjugierten Addition
Die konjugierte Addition kann nur stattfinden wenn neben einer C-C-Doppelbindung eine C=O- Gruppe (Carbonylgruppe) vorliegt. Befindet sich die C-C-Doppelbindung nicht in Konjugation, so kann auch keine konjugierte Addition erfolgen.

Auch wenn ein konjugiertes System vorliegt muss nicht zwingend eine konjugierte Addition ablaufen. Es ist ebenso möglich, dass das Nukleophil an der C=O-Gruppe angreift. Dies wird oft als 1,2-Addition bezeichnet und läuft wie folgt ab….

Unser Nukleophil (hier ein Cyanidion) greift an dem positiv polarisierten Kohlenstoffatom der C=O-Gruppe (Carbonylkohlenstoff) an, wobei sich eine tetraedrische Zwischenstufe bildet.
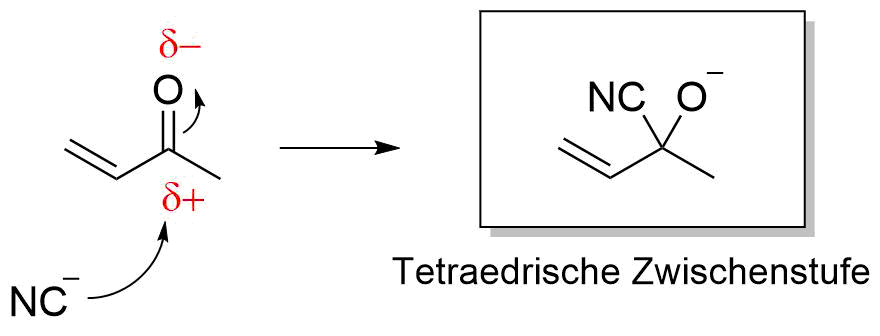
Nun bestehen zwei Möglichkeiten. Zum einen kann die tetraedrische Zwischenstufe protoniert werden und so das Produkt bilden, oder sie kann zum anderen “kollabieren” und wieder in die Ausgangsverbindungen zerfallen.
Der Mechanismus der konjugierten Addition verläuft anders. Das Nukleophil greift an der C-C-Doppelbindung an, was zu einem “Umklappen” der Bindungen führt. Hierbei entsteht ein Enolat, welches zum Enol protoniert werden kann. Durch eine Keto-Enol-Tautomerie kann das Enol im Anschluss zu einem Keton tautomersieren. Diese Reaktion funktioniert genau so auch für Aldehyde.

Exkurs: Warum 1,4- beziehungsweise 1,2-Addition?

Die Benennung erzeugt gerne mal Verwirrung, weshalb wir hier eine ausführlichere Erklärung für dich haben.
Das Gleichgewicht bei der Keto-Enol-Tautomerie ist auf die Seite des Ketons verschoben, weil die C-O-Doppelbindung energetisch günstiger ist als eine C-C-Doppelbindung. Aber auch hier gibt es Ausnahmen. Wenn das Enol zum Beispiel zu einem aromatischen System gehört, kann das Gleichgewicht auch zum Enol verschoben sein. Es gibt hierbei aber auch noch weitere Möglichkeiten das Gleichgewicht zu beeinflussen.
Warum erfolgt ein nukleophiler Angriff an der C-C-Doppelbindung ?
Meist gibt es eine offensichtliche Polarisierung die eine Reaktion verursacht. Es liegen also Part-ialladungen vor, welche das Nukleophil zum Angriff bringen . Dies ist auch hier der Fall, nur das die Ladungen nicht sofort zu erkennen sind. Schauen wir uns hierzu einmal die Mesomerengrenzstrukturen genauer an…

Warum eigentlich nicht...
Es ist noch eine weitere Grenzstruktur denkbar, aber diese ist eher unrealistisch.

Schau dir einmal die Elektronegativitäten der Atome an. Sauerstoff “zieht” am stärkesten und wird daher keine Elektronen abgeben.
Hier sehen wir nun das eine positive Ladung dort vorliegt wo die Doppelbindung sich befindet. Natürlich gibt es kein primäres Kation und die Realität wird irgendwo zwischen diesen beiden Strukturen liegen, aber wir können uns nun erklären warum das Nukleophil dort überhaupt angreifen kann.
Ähnliche Themen:
- Exkurs: Warum 1,2- und 1,4-Addition? Es kommt oftmals die Frage bei der konjugierten Addition auf, wie die Benennung der 1,2- und 1,4-Addition zustande kommt. Daher möchte ich das gern mit dir einmal besprechen. Der...